מגפות שפעת עונתיות גורמות מדי שנה בין 290,000 ל-650,000 מקרי מוות הקשורים למחלות נשימה ברחבי העולם. המדינה חווה מגפת שפעת קשה בחורף הזה לאחר סיום מגפת הקורונה. חיסון נגד שפעת הוא הדרך היעילה ביותר למנוע שפעת, אך לחיסון השפעת המסורתי המבוסס על תרבית עוברי עוף יש כמה חסרונות, כגון שונות אימונוגנית, מגבלות ייצור וכן הלאה.
הופעתו של חיסון נגד שפעת המבוסס על הנדסת גנים של חלבון HA רקומביננטי יכולה לפתור את הפגמים בחיסון המסורתי לעוברי עוף. נכון לעכשיו, הוועדה המייעצת האמריקאית לנוהלי חיסון (ACIP) ממליצה על חיסון שפעת רקומביננטי במינון גבוה למבוגרים מגיל 65 ומעלה. עם זאת, עבור אנשים מתחת לגיל 65, ACIP אינו ממליץ על אף חיסון שפעת המתאים לגיל כעדיפות עקב היעדר השוואות ראש בראש בין סוגי חיסונים שונים.
חיסון השפעת המהונדס גנטית (RIV4) מבוסס המגלוטינין רקומביננטי ארבע-ערכי (HA) אושר לשיווק במספר מדינות מאז 2016 והוא כיום חיסון השפעת הרקומביננטי המרכזי הנמצא בשימוש. RIV4 מיוצר באמצעות פלטפורמת טכנולוגיית חלבון רקומביננטי, שיכולה להתגבר על החסרונות של ייצור חיסונים מומתים מסורתיים, המוגבלים על ידי אספקת עוברי עוף. יתר על כן, לפלטפורמה זו מחזור ייצור קצר יותר, היא תורמת יותר להחלפה בזמן של זני חיסון מועמדים, ויכולה למנוע מוטציות אדפטיביות שעלולות להתרחש בתהליך הייצור של זנים נגיפיים שעלולים להשפיע על ההשפעה המגנה של חיסונים מוגמרים. קארן מידת'ון, דאז מנהלת המרכז לסקירת ומחקר ביולוגיים במנהל המזון והתרופות האמריקאי (FDA), ציינה כי "הופעתם של חיסוני שפעת רקומביננטיים מייצגת התקדמות טכנולוגית בייצור חיסוני שפעת... זה מספק פוטנציאל להפעלה מהירה יותר של ייצור חיסונים במקרה של התפרצות" [1]. בנוסף, RIV4 מכיל פי שלושה יותר חלבון המגלוטינין מחיסון שפעת קונבנציונלי במינון סטנדרטי, בעל אימונוגניות חזקה יותר [2]. מחקרים קיימים הראו כי RIV4 מגן יותר מחיסון נגד שפעת במינון סטנדרטי בקרב מבוגרים, ויש צורך בראיות מלאות יותר כדי להשוות בין השניים באוכלוסיות צעירות יותר.
ב-14 בדצמבר 2023, פרסם ה-New England Journal of Medicine (NEJM) מחקר של אמבר שיאו ואחרים, ממרכז המחקר לחיסונים Kaiser Permanente, מערכת הבריאות KPNC, אוקלנד, ארה"ב. המחקר הוא מחקר מציאותי שהשתמש בגישה אקראית לאוכלוסייה כדי להעריך את ההשפעה המגנה של RIV4 לעומת חיסון שפעת מומת במינון סטנדרטי מרובע (SD-IIV4) באנשים מתחת לגיל 65 במהלך שתי עונות שפעת בין השנים 2018 ל-2020.
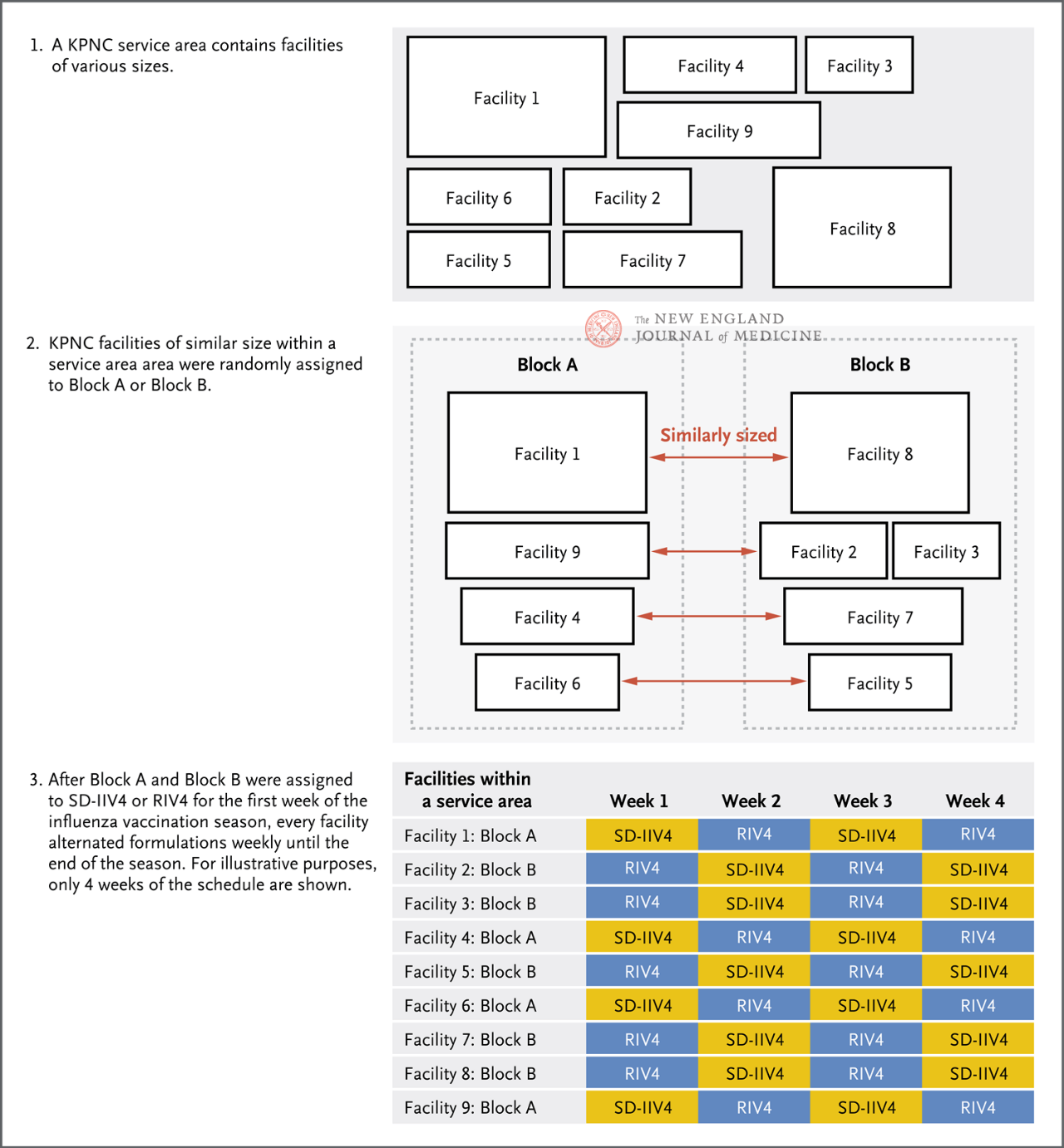
בהתאם לאזור השירות ולגודל המתקן של מתקני KPNC, הם חולקו באופן אקראי לקבוצה A או לקבוצה B (איור 1), כאשר קבוצה A קיבלה RIV4 בשבוע הראשון, קבוצה B קיבלה SD-IIV4 בשבוע הראשון, ולאחר מכן כל מתקן קיבל את שני החיסונים לסירוגין מדי שבוע עד סוף עונת השפעת הנוכחית. נקודת הסיום העיקרית של המחקר הייתה מקרי שפעת שאושרו באמצעות PCR, ונקודות הסיום המשניות כללו אשפוזים הקשורים לשפעת מסוג שפעת A, שפעת B ואשפוזים הקשורים לשפעת. רופאים בכל מתקן מבצעים בדיקות PCR לשפעת לפי שיקול דעתם, בהתבסס על המצג הקליני של המטופל, ומקבלים מידע על אבחונים באשפוז ובמרפאה חוץ, בדיקות מעבדה וחיסונים באמצעות רשומות רפואיות אלקטרוניות.
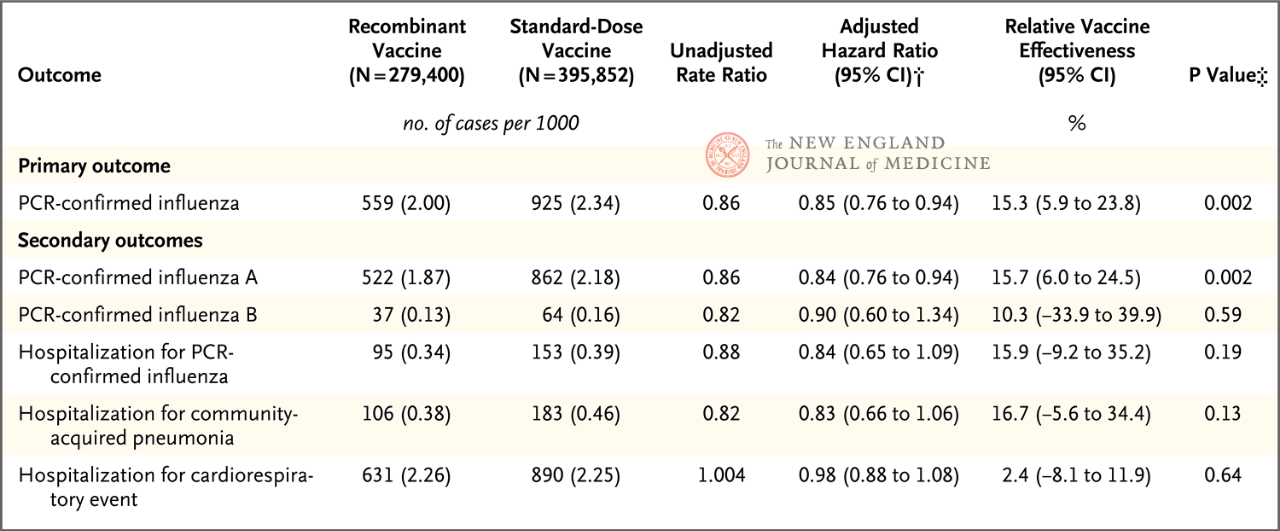
המחקר כלל מבוגרים בגילאי 18 עד 64 שנים, כאשר קבוצת הגיל העיקרית שנותחה הייתה גילאי 50 עד 64. התוצאות הראו כי ההשפעה המגנה היחסית (rVE) של RIV4 בהשוואה ל-SD-IIV4 כנגד שפעת שאושרה ב-PCR הייתה 15.3% (רווח בר-סמך 95%, 5.9-23.8) בקרב אנשים בגילאי 50 עד 64 שנים. ההגנה היחסית מפני שפעת A הייתה 15.7% (רווח בר-סמך 95%, 6.0-24.5). לא הוצגה השפעה מגנה יחסית מובהקת סטטיסטית עבור שפעת B או אשפוזים הקשורים לשפעת. בנוסף, ניתוחים גישוש הראו כי בקרב אנשים בגילאי 18-49 שנים, הן עבור שפעת (rVE, 10.8%; רווח בר-סמך 95%, 6.6-14.7) והן עבור שפעת A (rVE, 10.2%; רווח בר-סמך 95%, 1.4-18.2), RIV4 הראה הגנה טובה יותר מאשר SD-IIV4.
ניסוי קליני יעילות אקראי, כפול סמיות, מבוקר חיובי, קודם הראה כי ל-RIV4 הייתה הגנה טובה יותר מאשר ל-SD-IIV4 באנשים בני 50 ומעלה (rVE, 30%; רווח בר-סמך 95%, 10~47) [3]. מחקר זה מדגים שוב באמצעות נתונים אמיתיים בקנה מידה גדול שחיסוני שפעת רקומביננטיים מספקים הגנה טובה יותר מחיסונים מסורתיים מומתים, ומשלים את הראיות לכך ש-RIV4 מספק הגנה טובה יותר גם באוכלוסיות צעירות יותר. המחקר ניתח את שכיחות זיהום בנגיף סינציאלי נשימתי (RSV) בשתי הקבוצות (זיהום RSV אמור להיות דומה בשתי הקבוצות מכיוון שחיסון שפעת אינו מונע זיהום RSV), שלל גורמים מבלבלים אחרים, ואימת את חוסן התוצאות באמצעות ניתוחי רגישות מרובים.
שיטת התכנון האקראי הקבוצתית החדשה שאומצה במחקר זה, ובמיוחד החיסון המתחלף של החיסון הניסיוני וחיסון הביקורת על בסיס שבועי, איזנה טוב יותר את הגורמים המפריעים בין שתי הקבוצות. עם זאת, בשל מורכבות התכנון, הדרישות לביצוע המחקר גבוהות יותר. במחקר זה, אספקה לא מספקת של חיסון שפעת רקומביננטי הובילה לכך שמספר גדול יותר של אנשים שהיו צריכים לקבל RIV4 קיבלו SD-IIV4, מה שהביא להבדל גדול יותר במספר המשתתפים בין שתי הקבוצות ולסיכון אפשרי להטיה. בנוסף, המחקר תוכנן במקור להתקיים בין השנים 2018 ל-2021, והופעת נגיף הקורונה ואמצעי המניעה והבקרה שלו השפיעו הן על המחקר והן על עוצמת מגפת השפעת, כולל קיצור עונת השפעת 2019-2020 והיעדר עונת השפעת 2020-2021. נתונים זמינים רק משתי עונות שפעת "חריגות" בין השנים 2018 ל-2020, ולכן יש צורך במחקר נוסף כדי להעריך האם ממצאים אלה מתקיימים על פני עונות מרובות, זנים שונים במחזור ומרכיבי חיסון שונים.
בסך הכל, מחקר זה מוכיח עוד יותר את היתכנותם של חיסונים מהונדסים גנטית רקומביננטיים המיושם בתחום חיסוני השפעת, וגם מניח בסיס טכני איתן למחקר ופיתוח עתידיים של חיסוני שפעת חדשניים. פלטפורמת הטכנולוגיה של חיסוני הנדסה גנטית רקומביננטיים אינה תלויה בעוברי עוף, ויש לה יתרונות של מחזור ייצור קצר ויציבות ייצור גבוהה. עם זאת, בהשוואה לחיסוני שפעת מסורתיים מומתים, אין להם יתרון משמעותי בהגנה, וקשה לפתור את תופעת הבריחה החיסונית הנגרמת על ידי נגיפי שפעת בעלי מוטציה גבוהה מהשורש. בדומה לחיסוני שפעת מסורתיים, נדרשים ניבוי זנים והחלפת אנטיגנים מדי שנה.
לנוכח התפתחויות של גרסאות שפעת, עלינו עדיין לשים לב לפיתוח חיסוני שפעת אוניברסליים בעתיד. פיתוח חיסון שפעת אוניברסלי אמור להרחיב בהדרגה את היקף ההגנה מפני זני הנגיף, ובסופו של דבר להשיג הגנה יעילה מפני כל הזנים בשנים שונות. לכן, עלינו להמשיך לקדם בעתיד את תכנון חיסון רחב טווח המבוסס על חלבון HA, להתמקד ב-NA, חלבון שטחי נוסף של נגיף השפעת, כמטרת חיסון מרכזית, ולהתמקד בדרכי טכנולוגיית חיסון נשימתיות המועילות יותר בגרימת תגובות הגנה רב-ממדיות, כולל חסינות תאית מקומית (כגון חיסון בתרסיס לאף, חיסון באבקה יבשה לשאיפה וכו'). להמשיך לקדם את המחקר של חיסוני mRNA, חיסוני נשאים, אדג'ובנטים חדשים ופלטפורמות טכניות אחרות, ולהגשים את פיתוחם של חיסוני שפעת אוניברסליים אידיאליים ש"מגיבים לכל השינויים ללא שינוי".
זמן פרסום: 16 בדצמבר 2023