קכקסיה היא מחלה סיסטמית המאופיינת בירידה במשקל, ניוון שרירים ורקמת שומן ודלקת סיסטמית. קכקסיה היא אחד הסיבוכים העיקריים וגורמי המוות בחולי סרטן. בנוסף לסרטן, קכקסיה יכולה להיגרם על ידי מגוון מחלות כרוניות, לא ממאירות, כולל אי ספיקת לב, אי ספיקת כליות, מחלת ריאות חסימתית כרונית, מחלות נוירולוגיות, איידס ודלקת מפרקים שגרונית. ההערכה היא כי שכיחות הקכקסיה בחולי סרטן יכולה להגיע ל-25% עד 70%, דבר הפוגע קשות באיכות חייהם של החולים ומחמיר את הרעילות הקשורה לטיפול.
התערבות יעילה בקכקסיה היא בעלת חשיבות רבה לשיפור איכות החיים והפרוגנוזה של חולי סרטן. עם זאת, למרות התקדמות מסוימת בחקר המנגנונים הפתופיזיולוגיים של קכקסיה, תרופות רבות שפותחו על סמך מנגנונים אפשריים יעילות באופן חלקי בלבד או אינן יעילות. נכון לעכשיו, אין טיפול יעיל שאושר על ידי מנהל המזון והתרופות האמריקאי (FDA).
ישנן סיבות רבות לכישלון ניסויים קליניים בקכקסיה, והסיבה הבסיסית עשויה להיות חוסר הבנה מעמיקה של המנגנון והמהלך הטבעי של הקכקסיה. לאחרונה, פרופסור שיאו רויפינג והחוקר הו שינלי מהמכללה לטכנולוגיה עתידית של אוניברסיטת פקינג פרסמו במשותף מאמר בכתב העת Nature Metabolism, החושף את התפקיד החשוב של מסלול חומצת החלבון GPR81 בהופעת קכקסיה סרטנית, ומספק רעיון חדש לטיפול בקכקסיה. אנו מסכמים זאת על ידי סינתזה של מאמרים מ-Nat Metab, Science, Nat Rev Clin Oncol וכתבי עת אחרים.
ירידה במשקל נגרמת בדרך כלל מירידה בצריכת מזון ו/או עלייה בהוצאות האנרגיה. מחקרים קודמים הציעו כי שינויים פיזיולוגיים אלה בקכקסיה הקשורה לגידול מונעים על ידי ציטוקינים מסוימים המופרשים על ידי המיקרו-סביבה של הגידול. לדוגמה, גורמים כמו גורם התמיינות גדילה 15 (GDF15), ליפוקלין-2 וחלבון דמוי אינסולין 3 (INSL3) יכולים לעכב את צריכת המזון על ידי קשירה לאתרי ויסות תיאבון במערכת העצבים המרכזית, מה שמוביל לאנורקסיה אצל חולים. IL-6, PTHrP, אקטיבין A וגורמים אחרים גורמים לירידה במשקל ואטרופיה של רקמות על ידי הפעלת המסלול הקטבולי והגברת הוצאות האנרגיה. נכון לעכשיו, המחקר על מנגנון הקכקסיה התמקד בעיקר בחלבונים המופרשים הללו, ומעט מחקרים עסקו בקשר בין מטבוליטים של הגידול לקכקסיה. פרופסור שיאו רויפינג והחוקר הו שינלי נקטו בגישה חדשה כדי לחשוף את המנגנון החשוב של קכקסיה הקשורה לגידול מנקודת מבט של מטבוליטים של הגידול.
ראשית, צוותו של פרופסור שיאו רויפינג סקר אלפי מטבוליטים בדם של עכברים בריאים בקבוצת ביקורת ובמודל של קכקסיה של סרטן ריאות, ומצא שחומצה לקטית הייתה המטבוליט המוגבר ביותר בעכברים עם קכקסיה. רמת חומצת החלב בסרום עלתה עם צמיחת הגידול, והראתה מתאם חזק עם שינוי במשקל של עכברים נושאי גידול. דגימות סרום שנאספו מחולי סרטן ריאות מאשרות שחומצה לקטית ממלאת גם תפקיד מפתח בהתקדמות קכקסיה של סרטן ריאות בבני אדם.
כדי לקבוע האם רמות גבוהות של חומצה לקטית גורמות לקכקסיה, צוות המחקר הזרים חומצה לקטית לדם של עכברים בריאים באמצעות משאבה אוסמוטית שהושתלה מתחת לעור, ובכך העלתה באופן מלאכותי את רמות חומצת החלב בסרום לרמה של עכברים עם קכקסיה. לאחר שבועיים, העכברים פיתחו פנוטיפ טיפוסי של קכקסיה, כגון ירידה במשקל, ניוון רקמות שומן ושריר. תוצאות אלו מצביעות על כך שעיצוב מחדש של שומן הנגרם על ידי לקטט דומה לזה הנגרם על ידי תאי סרטן. לקטט אינו רק מטבוליט אופייני לקכקסיה של סרטן, אלא גם מתווך מרכזי של פנוטיפ היפר-קטבולי הנגרם מסרטן.
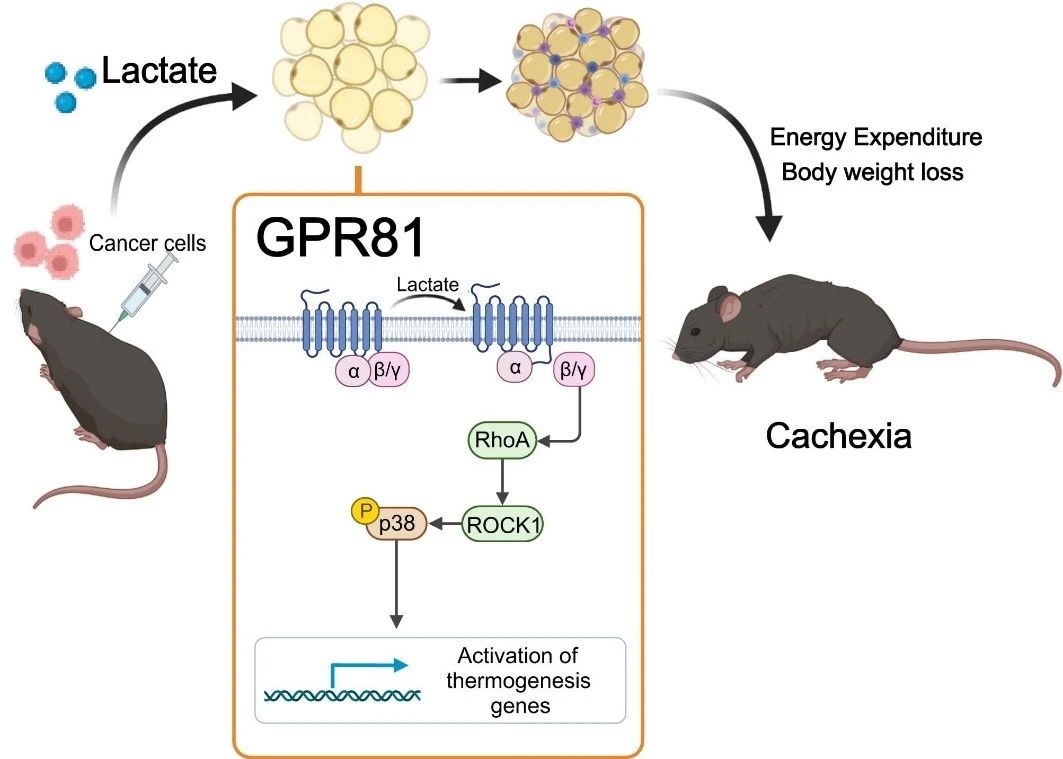
לאחר מכן, הם מצאו כי מחיקת קולטן הלקטט GPR81 הייתה יעילה בהקלה על ביטויי קכקסיה הנגרמת על ידי גידולים ולקטט בסרום מבלי להשפיע על רמות הלקטט בסרום. מכיוון ש-GPR81 מתבטא מאוד ברקמת שומן ומשתנה ברקמת השומן מוקדם יותר מאשר שרירי השלד במהלך התפתחות הקכקסיה, אפקט הנוקאאוט הספציפי של GPR81 ברקמת שומן של עכברים דומה לזה של נוקאאוט סיסטמי, ומשפר את הירידה במשקל הנגרמת על ידי גידול ואת צריכת השומן ושרירי השלד. ממצא זה מצביע על כך ש-GPR81 ברקמת שומן נדרש להתפתחות קכקסיה של סרטן המונעת על ידי חומצה לקטית.
מחקרים נוספים אישרו כי לאחר קשירה ל-GPR81, מולקולות חומצה לקטית מניעות השחמה שומנית, ליפוליזה וייצור חום מערכתי מוגבר דרך מסלול האיתות Gβγ-RhoA/ROCK1-p38, ולא מסלול PKA הקלאסי.
למרות תוצאות מבטיחות בפתוגנזה של קכקסיה הקשורה לסרטן, ממצאים אלה טרם תורגמו לטיפולים יעילים, ולכן כיום אין סטנדרטים טיפוליים עבור חולים אלה, אך אגודות מסוימות, כגון ESMO והאגודה האירופית לתזונה קלינית ומטבוליזם, פיתחו הנחיות קליניות. נכון לעכשיו, הנחיות בינלאומיות ממליצות בחום לקדם חילוף חומרים ולהפחית קטבוליזם באמצעות גישות כגון תזונה, פעילות גופנית ותרופות.
זמן פרסום: 28 באפריל 2024