השתלת ריאות היא הטיפול המקובל למחלות ריאות מתקדמות. בעשורים האחרונים, השתלת ריאות עשתה התקדמות ניכרת בסינון והערכה של מושתלים, בחירה, שימור והקצאה של ריאות תורמות, טכניקות כירורגיות, ניהול לאחר הניתוח, ניהול סיבוכים ודיכוי חיסוני.
במשך יותר מ-60 שנה, השתלת ריאות התפתחה מטיפול ניסיוני לטיפול סטנדרטי מקובל במחלות ריאות מסכנות חיים. למרות בעיות נפוצות כגון תפקוד לקוי של השתלת שתל ראשונית, תפקוד לקוי כרוני של ריאות בהשתלה (CLAD), סיכון מוגבר לזיהומים אופורטוניסטיים, סרטן ובעיות בריאות כרוניות הקשורות לדיכוי חיסוני, קיימת הבטחה לשיפור הישרדות המטופלים ואיכות חייהם באמצעות בחירת הנמען הנכון. בעוד שהשתלות ריאות הופכות נפוצות יותר ברחבי העולם, מספר הניתוחים עדיין אינו עומד בקצב הביקוש הגובר. סקירה זו מתמקדת במצב הנוכחי ובהתקדמות האחרונה בהשתלת ריאות, כמו גם בהזדמנויות עתידיות ליישום יעיל של טיפול מאתגר אך בעל פוטנציאל משנה חיים זה.
הערכה ובחירת נמענים פוטנציאליים
מכיוון שריאות תורמות מתאימות הן נדירות יחסית, מרכזי השתלה נדרשים מבחינה אתית להקצות איברים תורמים לנמענים פוטנציאליים בעלי הסיכוי הגבוה ביותר להפיק תועלת נטו מהשתלה. ההגדרה המסורתית של נמענים פוטנציאליים כאלה היא שיש להם סיכון מוערך של יותר מ-50% למות ממחלת ריאות תוך שנתיים וסיכוי של יותר מ-80% לשרוד 5 שנים לאחר ההשתלה, בהנחה שהריאות המושתלות מתפקדות במלואן. האינדיקציות הנפוצות ביותר להשתלת ריאות הן פיברוזיס ריאתי, מחלת ריאות חסימתית כרונית, מחלת כלי דם ריאתיים וסיסטיק פיברוזיס. מטופלים מופנים על סמך ירידה בתפקוד הריאות, ירידה בתפקוד הפיזי והתקדמות המחלה למרות השימוש המרבי בתרופות וטיפולים כירורגיים; קריטריונים ספציפיים אחרים למחלה נלקחים גם הם בחשבון. אתגרים פרוגנוסטיים תומכים באסטרטגיות הפניה מוקדמות המאפשרות ייעוץ טוב יותר ביחס סיכון-תועלת כדי לשפר קבלת החלטות משותפות מושכלת ואת ההזדמנות לשנות חסמים פוטנציאליים לתוצאות מוצלחות של השתלה. הצוות הרב-תחומי יעריך את הצורך בהשתלת ריאות ואת הסיכון של המטופל לסיבוכים לאחר ההשתלה עקב שימוש בתרופות מדכאות חיסון, כגון הסיכון לזיהומים שעלולים לסכן חיים. בדיקות סקר לאיתור תפקוד לקוי של איברים חוץ-ריאתיים, כושר גופני, בריאות נפשית, חסינות מערכתית וסרטן הן קריטיות. הערכות ספציפיות של עורקים כליליים ומוחיים, תפקודי כליות, בריאות העצם, תפקוד הוושט, יכולת פסיכו-סוציאלית ותמיכה חברתית הן קריטיות, תוך הקפדה על שקיפות כדי למנוע אי-שוויון בקביעת התאמה להשתלה.
גורמי סיכון מרובים מזיקים יותר מגורמי סיכון בודדים. חסמים מסורתיים להשתלה כוללים גיל מתקדם, השמנת יתר, היסטוריה של סרטן, מחלה קשה ומחלות מערכתיות נלוות, אך גורמים אלה עמדו לאחרונה בפני אתגרים. גיל המקבלים עולה בהתמדה, ועד שנת 2021, 34% מהמקבלים בארצות הברית יהיו מעל גיל 65, דבר המצביע על דגש גובר על גיל ביולוגי על פני גיל כרונולוגי. כעת, בנוסף למרחק ההליכה של שש דקות, לעיתים קרובות יש הערכה רשמית יותר של שבריריות, המתמקדת ברזרבות פיזיות ובתגובות צפויות לגורמי לחץ. שבריריות קשורה לתוצאות גרועות לאחר השתלת ריאות, ושבריריות קשורה בדרך כלל להרכב הגוף. שיטות לחישוב השמנת יתר והרכב גוף ממשיכות להתפתח, תוך התמקדות פחות ב-BMI ויותר בתכולת שומן ומסת שריר. כלים המבטיחים לכמת היצרות, אוליגומיוזיס וחוסן גופני מפותחים כדי לחזות טוב יותר את היכולת להתאושש לאחר השתלת ריאות. בעזרת שיקום ריאות לפני ניתוח, ניתן לשנות את הרכב הגוף ואת התשישות, ובכך לשפר את התוצאות.
במקרה של מחלה קשה חריפה, קביעת היקף התשישות ויכולת ההחלמה היא מאתגרת במיוחד. השתלות בחולים המקבלים הנשמה מכנית היו נדירות בעבר, אך כיום הופכות נפוצות יותר. בנוסף, השימוש בתמיכה בחיים חוץ-גופית כטיפול מעבר טרום השתלה גבר בשנים האחרונות. התקדמות הטכנולוגיה וגישה לכלי הדם אפשרו לחולים בהכרה שנבחרו בקפידה ועוברים תמיכה בחיים חוץ-גופית להשתתף בהליכי הסכמה מדעת ושיקום פיזי, ולהשיג תוצאות לאחר ההשתלה דומות לאלו של חולים שלא נזקקו לתמיכה בחיים חוץ-גופית לפני ההשתלה.
מחלה סיסטמית נלווית נחשבה בעבר להתווית נגד מוחלטת, אך כעת יש להעריך באופן ספציפי את השפעתה על תוצאות לאחר ההשתלה. בהתחשב בכך שדיכוי חיסוני הקשור להשתלה מגביר את הסבירות להישנות הסרטן, הנחיות קודמות לגבי גידולים ממאירים קיימים הדגישו את הדרישה שחולים יהיו נקיים מסרטן במשך חמש שנים לפני שיוכנסו לרשימת ההמתנה להשתלה. עם זאת, ככל שטיפולים בסרטן הופכים יעילים יותר, מומלץ כעת להעריך את הסבירות להישנות הסרטן על בסיס ספציפי למטופל. מחלה אוטואימונית סיסטמית נחשבה באופן מסורתי להתווית נגד, השקפה בעייתית משום שמחלת ריאות מתקדמת נוטה להגביל את תוחלת החיים של חולים כאלה. ההנחיות החדשות ממליצות כי יש להקדים להשתלת ריאות הערכה וטיפול ממוקדים יותר של המחלה כדי להפחית את ביטויי המחלה שעלולים להשפיע לרעה על התוצאות, כגון בעיות בוושט הקשורות לסקלרודרמה.
נוגדנים במחזור הדם כנגד תת-מחלקות ספציפיות של HLA עלולים לגרום לחלק מהנמענים הפוטנציאליים להיות אלרגיים לאיברי תורם ספציפיים, וכתוצאה מכך לזמני המתנה ארוכים יותר, סבירות מופחתת להשתלה, דחייה חריפה של איברים וסיכון מוגבר ל-CLAD. עם זאת, חלק מההשתלות בין נוגדנים מועמדים לסוגי תורמים השיגו תוצאות דומות עם משטרי דה-סנסיטיזציה לפני הניתוח, כולל החלפת פלזמה, אימונוגלובולינים תוך ורידיים וטיפול בתאי B.
בחירה ויישום של ריאה תורמת
תרומת איברים היא פעולה אלטרואיסטית. קבלת הסכמת התורם וכיבוד האוטונומיה שלו הם הגורמים האתיים החשובים ביותר. ריאות התורם עלולות להינזק מטראומה בחזה, החייאה, שאיבה, תסחיף, פגיעה או זיהום הקשורים למכונת הנשמה, או פגיעה נוירוגנית, ולכן ריאות תורם רבות אינן מתאימות להשתלה. ISHLT (החברה הבינלאומית להשתלת לב וריאה)
השתלת ריאות מגדירה קריטריונים מקובלים לתורם, המשתנים ממרכז השתלות למרכז השתלות. למעשה, מעט מאוד תורמים עומדים בקריטריונים "האידיאליים" לתרומת ריאות (איור 2). ניצול מוגבר של ריאות התורם הושג באמצעות הקלה בקריטריונים של התורם (כלומר, תורמים שאינם עומדים בסטנדרטים אידיאליים קונבנציונליים), הערכה מדוקדקת, טיפול פעיל בתורם והערכה חוץ גופית (איור 2). היסטוריה של עישון פעיל על ידי התורם היא גורם סיכון לתפקוד לקוי של השתל הראשוני אצל המקבל, אך הסיכון למוות משימוש באיברים כאלה מוגבל ויש לשקול זאת מול השלכות התמותה של המתנה ארוכה לריאה תורמת מאדם שלא עישן מעולם. שימוש בריאות מתורמים מבוגרים (מעל גיל 70) שנבחרו בקפדנות ואין להם גורמי סיכון אחרים יכול להשיג תוצאות דומות של הישרדות ותפקוד ריאות אצל המקבל כמו אלו של תורמים צעירים יותר.
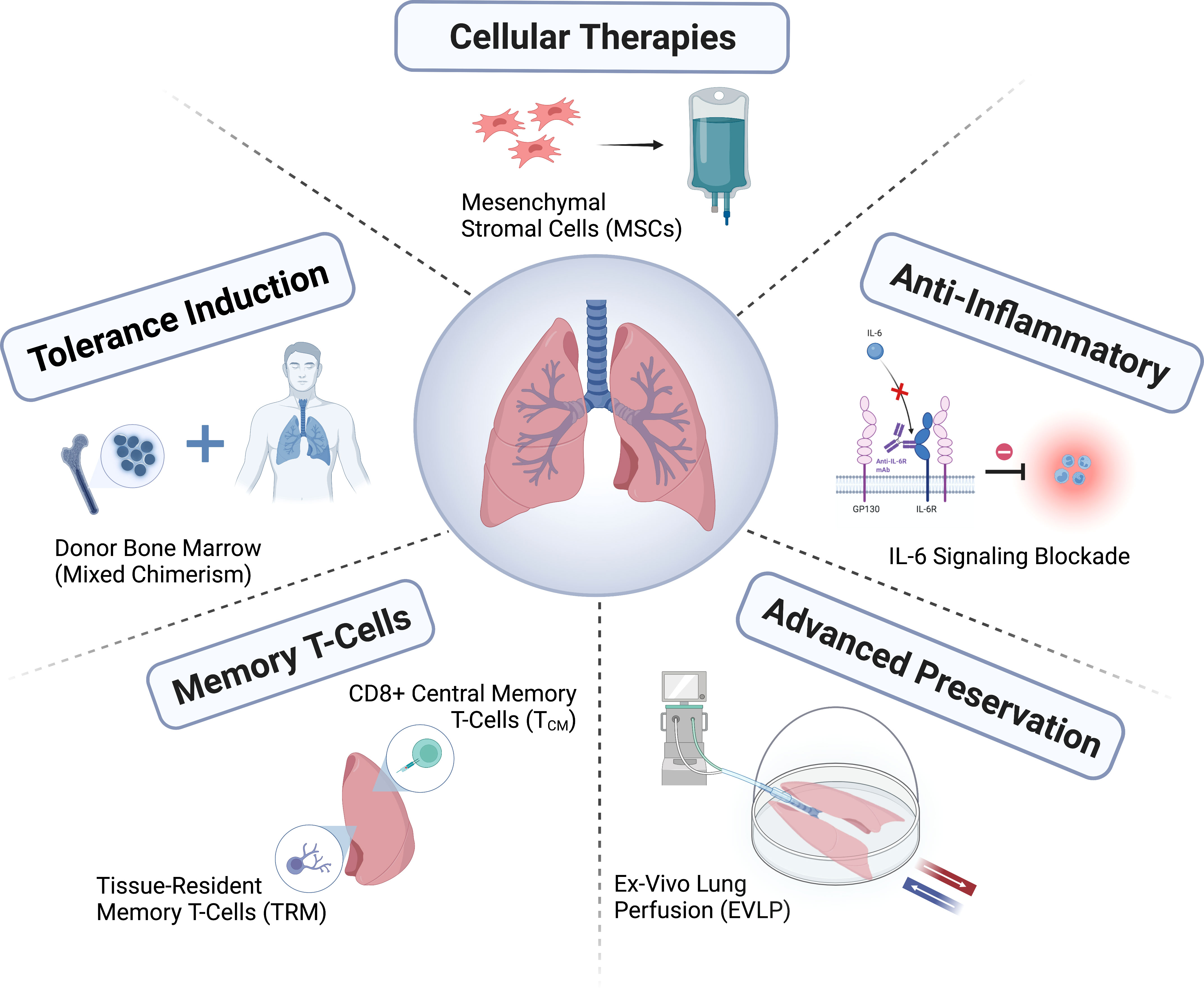
טיפול נאות בתורמי איברים מרובים ושקילת אפשרות לתרומת ריאות חיוניים על מנת להבטיח שריאות התורם יהיו מתאימות להשתלה. בעוד שמעטות מהריאות המסופקות כיום עונות על ההגדרה המסורתית של ריאה תורמת אידיאלית, הקלה בקריטריונים מעבר לקריטריונים מסורתיים אלה עשויה להוביל לניצול מוצלח של איברים מבלי לפגוע בתוצאות. שיטות סטנדרטיות לשימור ריאות מסייעות בהגנה על שלמות האיבר לפני שהוא מושתל במקבל. ניתן להעביר איברים למתקני השתלה בתנאים שונים, כגון שימור קריוסטטי או זילוח מכני בהיפותרמיה או בטמפרטורת גוף תקינה. ריאות שאינן נחשבות מתאימות להשתלה מיידית עשויות לעבור הערכה אובייקטיבית נוספת וניתן לטפל בהן באמצעות זילוח ריאות חוץ גופי (EVLP) או לשמר אותן לתקופות ארוכות יותר כדי להתגבר על חסמים ארגוניים להשתלה. סוג השתלת הריאות, ההליך והתמיכה התוך-ניתוחית תלויים כולם בצורכי המטופל ובניסיון והעדפות המנתח. עבור מושתלי ריאות פוטנציאליים שמחלתם מידרדרת באופן דרמטי בזמן ההמתנה להשתלה, תמיכה בחיים חוץ-גופית עשויה להיחשב כטיפול מעבר לפני ההשתלה. סיבוכים מוקדמים לאחר הניתוח עשויים לכלול דימום, חסימה של דרכי הנשימה או אנסטומוזה של כלי הדם, וזיהום בפצע. נזק לעצב הפרני או לעצב הואגוס בחזה יכול להוביל לסיבוכים אחרים, המשפיעים על תפקוד הסרעפת וריקון הקיבה, בהתאמה. ריאת התורם עלולה לסבול מפגיעה ריאתית חריפה מוקדמת לאחר השתלה ורפרפוזיה, כלומר תפקוד לקוי של השתל הראשוני. חשוב לסווג ולטפל בחומרת תפקוד לקוי של השתל הראשוני, הקשור לסיכון גבוה למוות מוקדם. מכיוון שנזק ריאתי פוטנציאלי של התורם מתרחש תוך שעות מהפגיעה המוחית הראשונית, ניהול הריאות צריך לכלול אוורור נאות, התרחבות מחודשת של האלוואולות, ברונכוסקופיה, שאיבה ושטיפה (לדגימת תרביות), ניהול נוזלים של המטופל והתאמת תנוחת בית החזה. ABO מייצג קבוצת דם A, B, AB ו-O, CVP מייצג לחץ ורידי מרכזי, DCD מייצג מוות לבבי של ריאה תורם, ECMO מייצג חמצון ממברנה חוץ-גופית, EVLW מייצג מים ריאתיים חוץ-וסקולריים, PaO2/FiO2 מייצג את היחס בין לחץ חמצן חלקי עורקי לריכוז חמצן בשאיפה, ו-PEEP מייצג לחץ חיובי בסוף הנשיפה. PiCCO מייצג את תפוקת הלב של צורת הגל של מדד הדופק.
במדינות מסוימות, השימוש בריאת תורם מבוקרת (DCD) עלה ל-30-40% בחולים עם מוות לבבי, ושיעורים דומים של דחיית איברים חריפה, CLAD והישרדות הושגו. באופן מסורתי, יש להימנע מהשתלת איברים מתורמים נגועים בנגיף מדבק למקבלים לא נגועים; עם זאת, בשנים האחרונות, תרופות אנטי-ויראליות הפועלות ישירות נגד נגיף הפטיטיס C (HCV) אפשרו להשתיל בבטחה ריאות תורמות חיוביות ל-HCV למקבלים שליליים ל-HCV. באופן דומה, ניתן להשתיל ריאות תורמות חיוביות לנגיף הכשל החיסוני האנושי (HIV) למקבלים חיוביים ל-HIV, וריאות תורמות חיוביות לנגיף הפטיטיס B (HBV) ניתנות להשתלה למקבלים שחוסנו נגד HBV ולאלו בעלי חסינות. דווח על השתלות ריאות מתורמים פעילים או קודמים שנדבקו ב-SARS-CoV-2. אנו זקוקים לראיות נוספות כדי לקבוע את בטיחות הדבקת ריאות תורמות בנגיפים מדבקים לצורך השתלה.
בשל המורכבות של קבלת איברים מרובים, מאתגר להעריך את איכות ריאות התורם. שימוש במערכת זילוח ריאות חוץ גופית (in vitro) להערכה מאפשר הערכה מפורטת יותר של תפקוד ריאות התורם והפוטנציאל לתקן אותו לפני השימוש (איור 2). מכיוון שריאת התורם רגישה מאוד לפגיעה, מערכת זילוח הריאות חוץ גופית מספקת פלטפורמה למתן טיפולים ביולוגיים ספציפיים לתיקון ריאת התורם הפגועה (איור 2). שני ניסויים אקראיים הראו כי זילוח ריאות חוץ גופית בטמפרטורת גוף תקינה של ריאות התורם העומדות בקריטריונים קונבנציונליים הוא בטוח וכי צוות ההשתלה יכול להאריך את זמן השימור בדרך זו. דווח כי שימור ריאות התורם בהיפותרמיה גבוהה יותר (6 עד 10 מעלות צלזיוס) במקום 0 עד 4 מעלות צלזיוס על קרח משפר את בריאות המיטוכונדריה, מפחית נזק ומשפר את תפקוד הריאות. עבור השתלות יום סלקטיביות למחצה, דווח כי שימור לילה ארוך יותר משיג תוצאות טובות לאחר ההשתלה. ניסוי בטיחות גדול שאינו נחות המשווה שימור ב-10 מעלות צלזיוס עם שימור קריוגני סטנדרטי נמצא כעת בעיצומו (מספר רישום NCT05898776 באתר ClinicalTrials.gov). אנשים מקדמים יותר ויותר שיקום איברים בזמן באמצעות מרכזי טיפול מרובי תורמים ושיפור תפקוד האיברים באמצעות מרכזי תיקון איברים, כך שניתן יהיה להשתמש באיברים באיכות טובה יותר להשתלה. ההשפעה של שינויים אלה על המערכת האקולוגית של ההשתלה עדיין נבדקת.
על מנת לשמר איברי DCD הניתנים לשליטה, ניתן להשתמש בזלוף מקומי של טמפרטורת גוף תקינה in situ באמצעות חמצון ממברנה חוץ-גופית (ECMO) כדי להעריך את תפקוד איברי הבטן ולתמוך ברכישה ישירה ושימור של איברי בית החזה, כולל הריאות. הניסיון בהשתלת ריאות לאחר זלזול מקומי של טמפרטורת גוף תקינה בחזה ובבטן מוגבל והתוצאות מעורבות. ישנם חששות שהליך זה עלול לגרום נזק לתורמים שנפטרו ולהפר את העקרונות האתיים הבסיסיים של קצירת איברים; לכן, זלזול מקומי בטמפרטורת גוף תקינה אינו מותר עדיין במדינות רבות.
סַרְטָן
שכיחות הסרטן באוכלוסייה לאחר השתלת ריאות גבוהה יותר מאשר באוכלוסייה הכללית, והפרוגנוזה נוטה להיות גרועה, ומהווה 17% ממקרי המוות. סרטן ריאות ומחלת לימפופרוליפרטיבית לאחר השתלה (PTLD) הם הגורמים השכיחים ביותר למוות הקשור לסרטן. דיכוי חיסוני ארוך טווח, השפעות של עישון קודם, או הסיכון למחלת ריאות בסיסית, כולם מובילים לסיכון לפתח סרטן ריאות בריאה של מקבל ריאה יחיד, אך במקרים נדירים, סרטן ריאות תת-קליני המועבר על ידי תורם יכול להופיע גם בריאות מושתלות. סרטן עור שאינו מלנומה הוא הסרטן הנפוץ ביותר בקרב מושתלים, ולכן ניטור קבוע של סרטן העור חיוני. PTLD של תאי B הנגרם על ידי נגיף אפשטיין-בר הוא גורם חשוב למחלה ולמוות. למרות ש-PTLD יכול להיעלם עם דיכוי חיסוני מינימלי, בדרך כלל נדרש טיפול ממוקד של תאי B עם ריטוקסימאב, כימותרפיה סיסטמית, או שניהם.
הישרדות ותוצאות ארוכות טווח
הישרדות לאחר השתלת איברים נותרה מוגבלת בהשוואה להשתלות איברים אחרות, עם חציון של 6.7 שנים, וחלה התקדמות מועטה בתוצאות ארוכות הטווח של המטופלים במשך שלושה עשורים. עם זאת, מטופלים רבים חוו שיפורים משמעותיים באיכות החיים, במצב הפיזי ובתוצאות אחרות שדווחו על ידי המטופלים; על מנת לבצע הערכה מקיפה יותר של ההשפעות הטיפוליות של השתלת ריאות, יש צורך להקדיש תשומת לב רבה יותר לתוצאות שדווחו על ידי מטופלים אלה. צורך קליני חשוב שלא נענה הוא לטפל במוות של מקבל השתלת איברים מסיבוכים קטלניים של כשל מאוחר של השתל או דיכוי חיסוני ממושך. עבור מקבלי השתלת ריאות, יש לתת טיפול פעיל ארוך טווח, הדורש עבודת צוות להגנה על בריאותו הכללית של המקבל על ידי ניטור ושמירה על תפקוד השתל מצד אחד, מזעור ההשפעות השליליות של דיכוי חיסוני ותמיכה בבריאותו הפיזית והנפשית של המקבל מצד שני (איור 1).
כיוון עתידי
השתלת ריאות היא טיפול שעבר כברת דרך ארוכה בזמן קצר, אך טרם הגיע למלוא הפוטנציאל שלו. המחסור בריאות מתורמות מתאימות נותר אתגר מרכזי, ושיטות חדשות להערכת וטיפול בתורמים, טיפול ותיקון ריאות תורמות ושיפור שימור התורמים עדיין מפותחות. יש צורך לשפר את מדיניות הקצאת האיברים על ידי שיפור ההתאמה בין תורמים למקבלים כדי להגדיל עוד יותר את התועלת נטו. יש עניין גובר באבחון דחייה או זיהום באמצעות אבחון מולקולרי, במיוחד באמצעות DNA חופשי שמקורו בתורם, או בהנחיית מזעור דיכוי חיסוני; עם זאת, התועלת של אבחונים אלה כתוספת לשיטות ניטור קליניות קיימות של שתלים נותרה ללא הכרעה.
תחום השתלות הריאות התפתח באמצעות הקמת קונסורציומים (למשל, מספר רישום ClinicalTrials.gov NCT04787822; https://lungtransplantconsortium.org) אשר פועלים יחד במניעה ובטיפול בתפקוד לקוי של השתל הראשוני, חיזוי CLAD, אבחון מוקדם וקביעת נקודות פנימיות (אנדוטיפינג), תסמונת ריפוי. חלה התקדמות מהירה יותר בחקר תפקוד לקוי של השתל הראשוני, דחייה בתיווך נוגדנים, ומנגנוני ALAD ו-CLAD. מזעור תופעות לוואי והפחתת הסיכון ל-ALAD ו-CLAD באמצעות טיפול מדכא חיסון מותאם אישית, כמו גם הגדרת תוצאות ממוקדות מטופל ושילובן במדדי תוצאה, יהיו המפתח לשיפור ההצלחה ארוכת הטווח של השתלת ריאות.
זמן פרסום: 23 בנובמבר 2024